电压门控钙离子通道(CaV)广泛存在于人体中,与肌肉收缩、神经递质释放、疼痛感知等一系列重要生理过程密切相关。N型钙离子通道CaV2.2主要存在于神经细胞的突触前膜,可以控制神经递质的释放。此外,CaV2.2也参与疼痛信号的传递,因此也被视为止痛药筛选的重要靶标之一。电压门控通道存在三个典型状态:静息态、开放态和失活态。钙离子通道的失活状态是防止通道持续开放,避免了神经递质的持续释放或者肌细胞发生强直收缩。尽管电压门控钙离子通道的失活性质至关重要,但是这一机制的结构基础仍不明确。
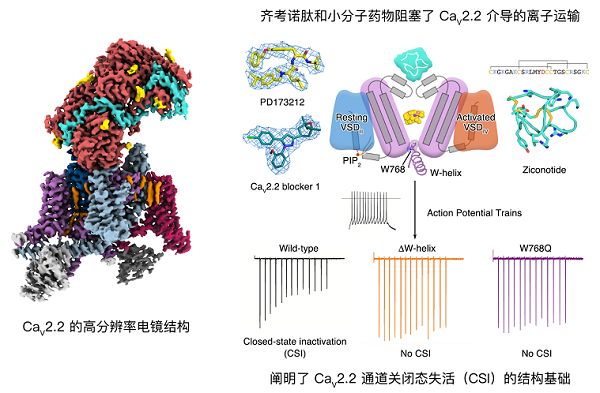
近期,中国科学院生物物理研究所赵岩课题组和北京大学药学院黄卓课题组、中科院物理研究所姜道华课题组解析了电压门控钙离子通道CaV2.2复合物在未结合底物状态(apo)、结合多肽镇痛剂齐考诺肽状态、结合两个小分子药物状态下的高分辨率冷冻电镜结构。
关闭态失活是少数电压门控钙离子通道所特有的性质。与开放态失活不同的是,CaV2.2在不能被激活的电压下,一部分通道直接进入失活状态。这对于短程突触可塑性以及神经递质释放的精确调控至关重要。该研究首次揭示了电压门控钙离子通道的关闭态失活(Closed-state inactivation)的结构基础。胞内侧W-helix存在于Domain I-II之间的连接区域,该螺旋中的第768位色氨酸(W768)的疏水侧链插入了CaV2.2关闭的胞内侧疏水门控区域,稳定了通道的失活状态。电生理实验表明,野生型CaV2.2展现出关闭态失活的现象。将W-helix删除或者引入W768Q突变之后,关闭态失活现象消失。同时,该研究设计了关闭态失活后恢复实验,发现W-helix和 W768Q突变的CaV2.2通道能更快地从失活中恢复,进一步在电生理水平上验证了W-helix是介导CaV2.2关闭态失活特性的重要结构元件。
该研究还报道了多肽镇痛剂“齐考诺肽”、小分子抑制剂与CaV2.2的复合物结构。齐考诺肽结合在孔道结构域的上方,阻碍了钙离子接近选择性滤器。小分子抑制剂结合在选择性过滤器的下方,同样可以抑制钙离子的内流。这部分内容揭示了对于CaV2.2不同的抑制机理,为开发CaV2.2通道特异的治疗疼痛的药物奠定了结构基础。
相关成果发表在Cell Reports上。研究得到中科院战略性先导科技专项、国家自然科学基金委资助。
医刊汇,科研学术服务平台
医刊汇是一家专业从事生物医学领域服务的公司,提供SCI医学论文、临床科研等服务,成立至今,已赢得众多科研工作者的好评。医刊汇拥有雄厚的学术背景,网罗了上百位具有欧美国作家协会认证资格的专家团队,为科研工作者提供全面、及时、准确的一站式科研服务。
未来,公司将继续秉承科学、严谨的工作精神,凭借卓越的团队学术优势为客户提供一流的科研服务;将秉承人才兴业原则,加强人才队伍建设工作,务实操作,用好资源,联强联大,充分发挥公司人才、资源、管理和品牌等资源优势,提升企业在市场中的竞争能力。










