为了应对许多类型的应激,真核细胞启动了一种适应性的和可逆的反应,包括下调关键的细胞活动,同时将细胞质中的mRNA封存到称为应激颗粒(stress granule)的结构中。伴随着这些应激反应的是泛素化的全局性增加,传统上人们认为这种情形是由于需要降解错误折叠或受损的蛋白质。然而,人们还没有详细表征泛素组(ubiquitinome)如何在应激反应中被重塑。此外,目前还不清楚应激依赖性的泛素化是否在更大的应激反应中发挥了更复杂的作用,而不仅仅是其已知的靶向危险蛋白使其遭受蛋白酶体降解的保护功能。
为了探索泛素化在应激反应中的作用,来自美国圣犹大儿童研究医院的研究人员在一项新的研究中,使用串联泛素结合实体(tandem ubiquitin binding entity, TUBE)蛋白质组学研究了体外培养的哺乳动物细胞(包括人类诱导多能干细胞(ipsC)衍生的神经元)对五种不同类型的应激反应中发生的泛素化变化。这种意料之外的泛素化模式的发现,促使这些作者通过使用diGly泛素残余物分析和串联质谱标签定量蛋白质组学,并结合额外的总蛋白质组和转录组分析,详细分析了热休克特异性诱导的泛素化模式。从这种新定义的“热休克泛素组(heat shock ubiquitinome)”中得到的新见解可指导随后对这种翻译后修饰在细胞对热休克反应中的功能重要性的调查。相关研究结果发表在2021年6月25日的Science期刊上,论文标题为“Ubiquitination is essential for recovery of cellular activities after heat shock”。
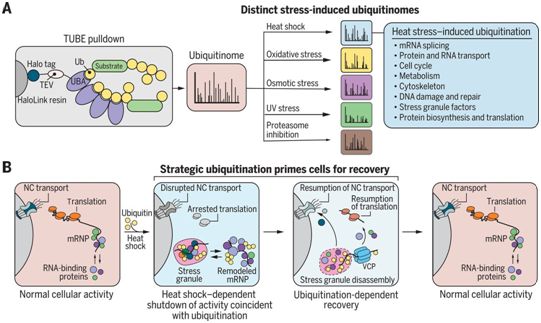
这五种不同类型的应激都诱发了独特的泛素化模式。人类人胚胎肾293T细胞中的热休克泛素组是由在应激过程中下调细胞活动(如翻译和核质运输)的特定蛋白质的泛素化定义的,这种模式在U2OS细胞、原代小鼠神经元和人类ipsC衍生的神经元中相似。热休克泛素组也富集于应激颗粒的蛋白质成分中。令人惊讶的是,这种应激诱导的泛素化对于应激颗粒的形成和细胞通路的关闭是非必要的;相反,一旦从应激中恢复过来,热休克诱导的泛素化是p97/含缬氨酸蛋白(VCP)介导的应激颗粒分解和恢复包括核质运输和翻译在内的正常细胞活动的先决条件。许多泛素化事件是针对一种或另一种应激的。例如,泛素化对热应激诱导的应激颗粒的分解是必需的,但对氧化(亚砷酸盐)应激诱导的应激颗粒的分解是不需要的。
泛素化模式对不同类型的应激具有特异性,这表明除了清除错误折叠或受损的蛋白质外,应激诱导的泛素化还有其他调节功能。具体来说,热休克诱导的泛素化通过靶向参与应激期间下调的几种途径中的特定蛋白质,使细胞从应激中恢复过来。此外,一些关键的应激颗粒成分在应对热应激而不是亚砷酸盐应激时发生泛素化,因此,VCP介导的热休克诱导的应激颗粒的分解机制并不是亚砷酸盐应激诱导的应激颗粒所共有的。最后,这些作者的深度蛋白质组学数据集提供了丰富的科学界资源,阐明了泛素化在应激反应中作用的其他方面。










