RNA干扰(RNAi)提供了特异性靶向mRNA并在其生物合成之前调节相应蛋白质表达的机会,因此已被建议作为一种有前途的治疗工具来操纵疾病相关基因的表达,尤其是被认为是不可食用的基因使用传统方法。但是,RNAi治疗遇到了许多问题,并且在临床翻译过程中远远落后于预期。
基于此,南京大学的张辰宇团队在《Cell Research》杂志发表了题为“In vivo self-assembled small RNA as a new generation of RNAi therapeutics”的论文,报道了一种利用合成生物学理念设计的基因环路实现siRNA体内高效递送的新技术。
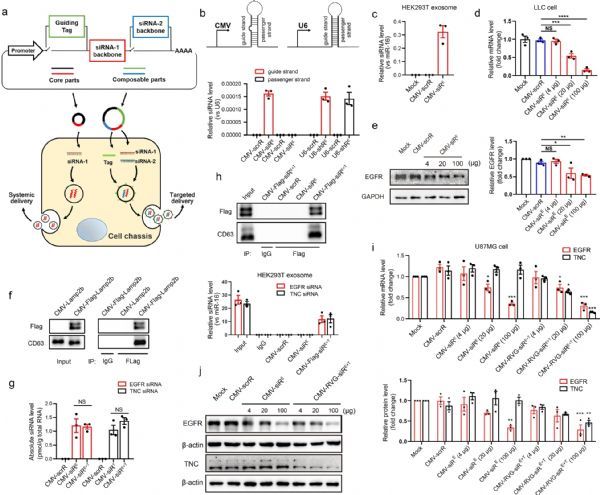
该研究团队合理设计了一种分层的遗传电路体系结构,该体系结构允许不同功能模块的自由组合。核心电路由启动子部分和siRNA表达部分组成,旨在产生和组织siRNA作为外泌体的有效载荷。然后可以将其他可组合部分(插件)集成到核心电路的框架中,以实现即插即用功能。例如,整合了两种类型的可组合部分以优化siRNA的作用:一种修饰外泌体的膜锚定蛋白,以实现组织选择性;另一种是修饰外泌体的膜锚定蛋白。另一个能够共表达第二个siRNA,以同时下调两个分子靶标。
接下来,该研究团队评估了遗传回路对胰岛素信号传导的影响。胰岛素通过对周围组织(例如,肝脏和肌肉)的胰岛素受体的直接作用和对中枢神经系统中胰岛素受体的间接作用来控制葡萄糖的稳态。虽然神经元PTP1B缺陷型小鼠瘦了并且对胰岛素过敏,但肝脏中PTP1B的缺乏只会提高胰岛素敏感性,而对体重和肥胖的影响很小。与此观点一致,在CMV-SIR P从外周循环的组来显示显著增强葡萄糖清除在葡萄糖耐量试验,胰岛素耐受性测试中的血糖降低和基础血清胰岛素浓度降低,但体重和脂肪仅略有减少。
最后,由于该研究团队的系统利用宿主肝脏作为体内siRNA自组装的生物生成器,因此该研究团队期望与免疫系统之间几乎没有相互作用。为了证明这一点,该研究团队比较了免疫缺陷裸鼠和具有免疫能力的宽型小鼠中遗传电路的目标沉默效率。CMV-siR E和CMV-RVG-siR E + T电路在裸鼠和宽型小鼠中均有效地抑制了它们的靶EGFR基因,表明免疫系统几乎没有影响关于体内自组装siRNA的产生。
综上所述,该研究团队的策略在异质动态的体内环境中诱导了可控的和可预测的siRNA自组装和递送,并允许以目的驱动模式精确控制基因表达。这项最先进的技术具有重大的理论意义和翻译价值,因为它提供了一种可行的策略来克服RNAi体内治疗应用的最重要障碍,从而代表了适用于多种疾病的新一代RNAi治疗剂从癌症到代谢疾病。










